電負度反映了元素對於成鍵電子的吸引能力,是一個衡量元素金屬性或非金屬性的重要指標。非金屬的電負度普遍高於 2.0,其中,氟元素具有最高的電負度(4.0),而金屬的電負度則低於 2.0,鍅元素的電負度最低(0.71)。此外,電負度還可以判斷化合物的正負化合價和化學鍵的類型。
| 元素類別 | 電負度 | 化學特性 |
|---|---|---|
| 非金屬 | ≥2.0 | 強烈的氧化性,易形成負離子 |
| 金屬 | <2.0 | 容易還原,傾向形成正離子 |
需要注意的是,非金屬的電負度雖然接近,但並不能直接反映其活性大小。活性大小與元素的氧化還原特性更密切相關。例如,鹵素元素(氟、氯、溴、碘)具有極高的氧化性,毒性強,活性順序為:氟 > 氯 > 溴 > 碘。
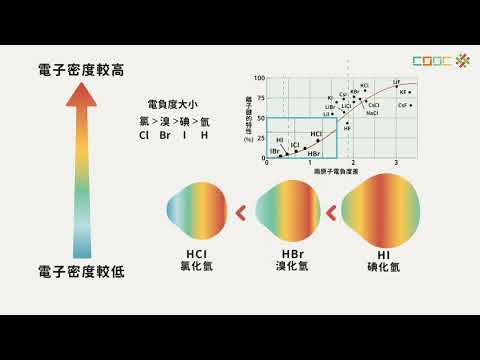

電負度與原子的核電荷和原子半徑密切相關。同一週期中,核電荷遞增,原子半徑遞減,電負度遞增。同族元素中,原子半徑增大,電負度減小。週期表右上方的非金屬元素電負度最高,左下方的金屬元素電負度最低。
根據電負度,可以判斷化合物中元素的化合價和判斷化學鍵的類型。電負度高的元素在化合物中表現為負化合價,電負度低的元素表現為正化合價。共價鍵中,共用電子對傾向於偏移向電負度高的原子,使鍵帶有極性。當化學鍵兩端元素的電負度相差很大(例如大於 1.9)時,所形成的鍵稱為離子鍵。

簡而言之,電負度是一個衡量元素在化學反應中吸引電子的能力,可以幫助理解非金屬和金屬的化學性質,以及化學鍵的性質。
電負度口訣:讓你快速記住電負度的規律
電負度口訣是一個幫助你快速記住電負度規律的口訣。這個口訣是:「氟氯溴碘比氧氮,氫鋰鈉鉀鎂鋁鈣」。
電負度是指一個原子吸引其價電子的能力。電負度高的元素有較強的吸引電子能力,而電負度低的元素則較弱。氟是最電負的元素,而銫是最不電負的元素。
根據 電負度口訣,我們可以記住以下規律:
- 同週期元素中,由左至右電負度遞增。
- 同族元素中,由上至下電負度遞減。
表格:電負度口訣對應的元素
| 順序 | 元素 |
|---|---|
| 1 | 氟(F) |
| 2 | 氯(Cl) |
| 3 | 溴(Br) |
| 4 | 碘(I) |
| 5 | 氧(O) |
| 6 | 氮(N) |
| 7 | 氫(H) |
| 8 | 鋰(Li) |
| 9 | 鈉(Na) |
| 10 | 鉀(K) |
| 11 | 鎂(Mg) |
| 12 | 鋁(Al) |
| 13 | 鈣(Ca) |
應用
電負度口訣可以幫助你預測化學鍵的性質。電負度差異大的元素之間形成的化學鍵是離子鍵,而電負度差異小的元素之間形成的化學鍵是共價鍵。
例如,氟和鈉之間的電負度差異很大(氟的電負度為 4.0,鈉的電負度為 0.9),因此它們形成離子鍵。而碳和氫之間的電負度差異較小(碳的電負度為 2.5,氫的電負度為 2.1),因此它們形成共價鍵。
結論

