文章內容目錄
非金屬活躍度與電負性
在化學領域,非金屬的活性與電負性之間存在著密切的聯繫。電負性是一種量化原子吸引電子能力的指標。
| 非金屬 | 氧化劑強度 | 電負性 |
|---|---|---|
| 氟 | 強 | 4.0 |
| 氯 | 3.0 | |
| 溴 | 2.8 | |
| 碘 | 2.5 |
活性大小
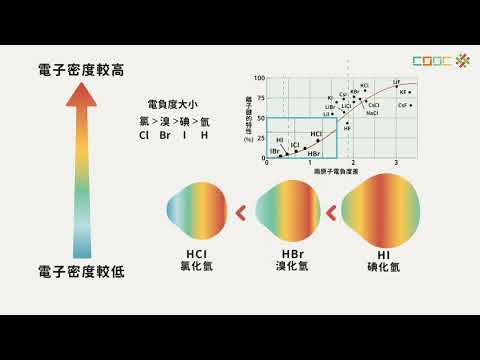

電負性越大,原子吸引電子的能力越強,非金屬的活性越大。根據表中數據,氟的電負性最大,因此是活性最強的非金屬。隨著電負性的降低,其他非金屬的活性也依次降低。
毒性與氧化力

鹵素(氟、氯、溴、碘)是非金屬中電負性最強、活性最高的元素,它們的氧化力極強,具有毒性。
電負性和化學性質
電負性還影響非金屬的化學性質。電負性高的非金屬在化學反應中傾向於獲得電子,形成負離子。電負性低的非金屬則傾向於失去電子,形成正離子。
電負性在化學鍵中的作用
在共價鍵中,電負性高的原子會吸引更多的電子,導致鍵的極性增加。如果電負性差值較大(>1.9),則形成離子鍵。
電負性高的非金屬與電負性低的金屬結合時,會形成離子鍵。例如,鈉(電負性0.9)和氟(電負性4.0)結合形成氯化鈉(NaCl),其中鈉離子帶正電荷,氟離子帶負電荷。
隨著非金屬元素電負性增加,其吸引電子的傾向也會增加,非金屬性質也會增強。電負性是量化原子吸引電子能力的關鍵指標,它對非金屬的活性大小、氧化力、化學性質和化學鍵的類型都有著重要的影響。
電負度大小口訣:掌握元素電負性的關鍵
電負度大小口訣,是記憶元素電負性大小的簡便方法,有助於迅速瞭解元素的電負性趨勢。
電負度大小口訣
週期錶行:從上到下,電負度 遞減。
週期表列:從左到右,電負度 遞增。
週期表電負度趨勢
| 週期 | 族別 | 電負度 |
|---|---|---|
| 第 1 週期 | 第一族 | 0.9 |
| 第 1 週期 | 第二族 | 1.0 |
| 第 1 週期 | 第三族 | 2.0 |
| 第 2 週期 | 第一族 | 0.8 |
| 第 2 週期 | 第二族 | 1.0 |
| 第 2 週期 | 第三族 | 1.3 |
| 第 3 週期 | 第一族 | 0.7 |
| 第 3 週期 | 第二族 | 1.0 |
| 第 3 週期 | 第三族 | 1.5 |
應用電負度大小口訣
電負度大小口訣可應用於化學反應的預測和理解。例如:
- 形成離子鍵:電負性差異大的元素容易形成離子鍵,電負性大的元素傾向於形成陰離子,電負性小的元素傾向於形成陽離子。
- 化合物的極性:兩個元素的電負性差異越大,化合物的極性越大。
- 強酸弱鹼:具有高電負性元素的酸較強,具有低電負性元素的鹼較強。
異常元素
儘管電負度大小口訣提供了元素電負性的一般趨勢,但仍有一些元素的電負性與預期不符。例如:
- 氯(Cl):位於氟(F)的下方,理論上應具有較大的電負性,但實際上它的電負性略小於氟。
- 硫(S):位於氧(O)的下方,理論上應具有較大的電負性,但實際上它的電負性略小於氧。
這些異常可歸因於這些元素的電子組態或分子軌道結構。
電負度與化學性質
電負性與化學性質密切相關,包括:

